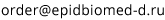Иммуноферментная тест-система для серодиагностики герпеса 2 типа
На основе рекомбинантного белка gG2 (JSC Diaproph-Med) сконструировано тест-систему для выявления иммуноглобулинов класса G к вирусу герпеса 2 типа и определения индекса их авидности. Данную тест-систему можно использовать как для подтверждения первичной инфекции, так и для дифференциации первичного заболевания от хронического инфекционного процесса и реактивации вируса. Таким образом, разработанная нами тест-система может быть дополнительным методом диагностики герпетической инфекции.
Инфицирование вирусом простого герпеса 2 (ВПГ2) типа является причиной большинства случаев хронического и рецидивирующего генитального герпеса. Для данной инфекции характерны горизонтальный (от больного к здоровому половым путем) и вертикальный (от матери плоду) способы передачи [1].
Несмотря на высокую гомологию с родственным вирусом простого герпеса 1 типа ВПГ2 является более опасным, поскольку характеризуется выраженным тропизмом к эпителиоцитам слизистых оболочек полового тракта и длительная персистенция вируса может приводить к онкогенной трансформации зараженных клеток [2]. Инфекция, обусловленная ВПГ2, характеризуется более частыми рецидивами, в сравнении с ВПГ1-инфекцией, и может быть причинами невынашивания беременности и развития врожденных патологий плода. [3, 4].
Рис. 1. Схематическое строение вируса простого герпеса.
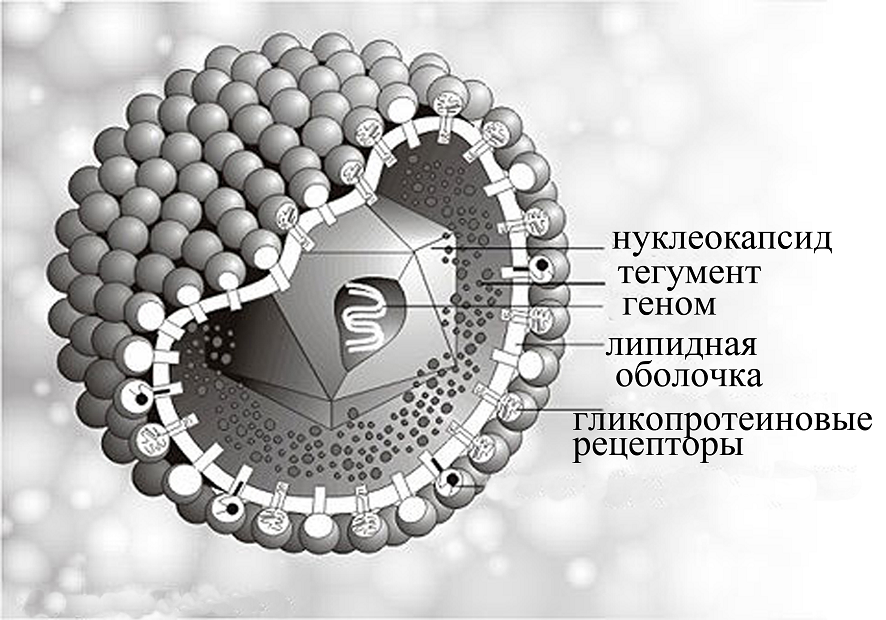
Диагностическое значение при первичном инфицировании ВПГ2 имеют IgM, которые определяются в крови на 4-6 сутки после контакта с вирусом и достигают максимального значения на 15-20 сутки. С 10-14 суток начинается продукция специфических IgG, которые персистируют в органихме на протяжении всей жизни [5]. Поэтому, серологические методы позволяют диагностировать заболевание как в период активации вируса, так и во время латентной инфекции. Антитела класса М к ВПГ2 выявляются в организме не только при первичной инфекции, но также и при реактивации вируса и реинфекции. В связи с этим, при установлении факта первичного инфицирования обязательным является определение авидности специфичесикх антител класса G [6, 7].
Рис. 2. Развитие иммунного ответа при герпетической инфекции
Авидность – это показатель сродства активного центра антитела к антигенным детерминантам возбудителя, который пропорционален степени прочности иммунного комплекса. Высокоаффинные антитела имеют преимущество в реакции антиген-антитело благодаря формированию к более устойчивых связей, что обусловлено эффективными конформационными изменениями их активных центров.
Антитела с высоким индексом авидности формируют высокоэнергетические иммунные комплексы с низкой тенденцией к диссоциации, и наоборот, антитела с низким индексом авидности образуют комплексы, для диссоциации которых необходимо меньше энергии. На этом свойстве базируется метод определения индекса авидности антител в присутствии хаотропных агентов (мочевина, гуанидина гидрохлорид, изотиоцианат натрия), низкие концентрации которых препятствуют возникновению иммунных комплексов, в состав которых входят только низкоавидные антитела.
Специфические IgG с низкой авидностью определяются тлько на ранних этапах первичной герпетической инфекции, что и даёт возможность дифференцировать ёё от хронического рецидивирующего заболевания [8].
Перспективным направлением в серодиагностике ВПГ2 является разработка различных конструкций твердофазного ИФА. Использование типоспецифического рекомбинантного белка gG2 даёт возможность дифференцировать герпетическую инфекцию, вызванную ВПГ2, от заболеваний вызванных подобным вирусом ВПГ1, что имеет существенное прогностическое значение и определяет дальнейшую стратегию лечения. [7, 9].
Материалы и методы
Исследовали 510 образцов сывороток крови доноров, переданных областной станцией переливания крови Киевской области. Все образцы были подтверждены в тест-системе «AMERICA Herpes 2 IgG Antibody ELISA Test Kit» (IBL, США).
Иммуноферментная тест-система для определения иммуноглобулинов класса G была сконструирована в формате непрямого твердофазного ИФА.
Для приготовления иммуносорбента использовали 96-луночные планшеты PolySorp (NUNC, Дания), лунки которого были очищенным рекомбнантным белком gG2 HSV2 производства ЧАО НПК «Диапроф Мед» (Киев, Украина).
Данный рекомбинантный белок gG2, состоящий из 68 аминокислот, является антигенным аналогом иммунодоминантных участков поверхностного гликопротеина G ВПГ2. При конструировании продуцента рекомбинантного белка использовали плазмидный вектор pET28а (Novagen, США) и клеточную систему реципиентного штамма Esherichia coli BL21(DE3).
Постановку ИФА проводили двухэтапно. На первом этапе, при внесении в лунки планшета исследуемых сывороток, содержащиеся в них специфические антитела связывались с соответствующими антигенами иммуносорбента. На следующем этапе образованные иммунные комплексы выявляли с помощью пероксидазного конъюгата на основе мышиных моноклональных антител к IgG человека.
В качестве проявителя реакции использовали 0,03% раствор 3,3’,5,5’- тетраметилбензидина в цитратном буфере, который содержал 0,016% перекиси водорода (субстрат для фермента пероксидазы). Развитие цветной реакции останавливали 0,5М серной кислотой. Оптическую плотность реакционной смеси в лунках определяли спектрофотометром Labsystems Multiskan (Финляндия) в двухволновом режиме 492/620 нм. Результат считали положительным, если его оптическая плотность (ОП) превышала граничное значение (cut off), которое рассчитывали как сумму среднего значения трёх негативных контролей с учетом коэффициента 0,2.
В качестве негативного контроля использовали сыворотку крови человека, которая не содержала антител к ВПГ1, ВПГ2, вирусу гепатита С, T.pallidum, а также HBsAg вируса гепатита В.
Для определения индекса авидности исследуемую положительную сыворотку инкубировали в двух параллельных лунках иммуносорбента, потом одну из них промывали в обычном режиме, а другую обрабатывали диссоциирующим раствором, который приводит к разрушению иммунных комплексов, образованных низкоавидными антителами. Индекс авидности рассчитывали как соотношение оптической плотности, полученной при выявлении специфических антител в присутствии диссоциирующего агента, к оптической плотности, полученной в результате анализа данного образца без обработки диссоциирующим раствором.
Если индекс авидности был меньше 30% считали, что сыворока содержит низкоавидные антитела; больше 60% - высокоавидные; а в диапазоне от 30% до 60% - средний уровень авидности антител.
Для разведения исследуемых образцов и конъюгата использовали фосфатный буфер с добавлением белка казеиновой фракции молока и детергента Tween 20 в качестве компонентов, которые блокируют неспецифические сигналы.
Для промывания планшетов после каждого этапа использовали фосфатный буфер с добавлением детергента Triton-X100.
Каждую сыворотку тестировали в четырёх повторах. Обработку полученных результатов проводили с учётом критерия Стьюдента [11].
Результаты и обсуждение
Для определения качественных характеристик разработанной нами тест-системы, предназначенной для определения IgG к ВПГ2, было исследовано 510 сывороток крови доноров. Полученные результаты представлены на рис.3.
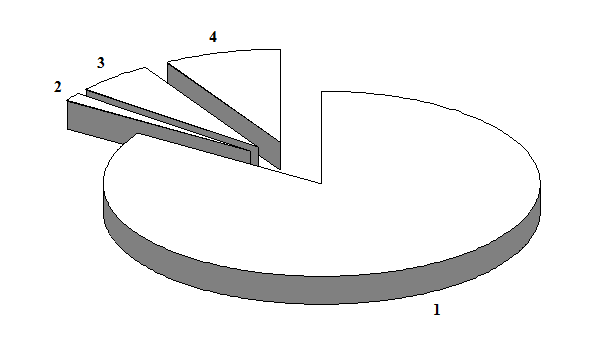
Рис.3. Распределение антител класса G, специфичных к ВПГ2, среди доноров: 1 – количество сывороток, не содержащих антитела к ВПГ2; 2 – количество сывороток, содержащих специфичные антитела с низким индексом авидности; 3 – количество сывороток, содержащих специфичные антитела со средним индексом авидности; 4 – количество сывороток, содержащих специфичные антитела с высоким индексом авидности.
Среди проанализированных образцов в 96 (18,8%) сыворотках выявлены специфические антитела класса G, а остальные 414 (81,2%) – были серонегативными. Такие данные соответствуют распространённости вируса в странах восточной Европы [12].
Определение индекса авидности специфических IgG основывается на способности связи антиген-антитело разрушаться под воздействием диссоциирующего раствора. Прочность иммунного комплекса определяется степенью сродства активного центра антитела с антигенными детерминантами вируса, что зависит от длительности и продуктивности заболевания.
При тестировании доноров с помощью разработанной тест-системы в наших исследованиях антитела класса G с низким индексом авидности - до 30% были выявлены у 8 серопозитивних доноров. Это свидетельствует о первичном инфицировании ВПГ2, поскольку контакт с вирусом состоялся сравнительно недавно и активные центры антител в процессе иммунного ответа еще не приобрели высокой степени сродства к антигену.
Специфические IgG с высоким индексом авидности – более 30% - были выявлены у 88 серопозитивных доноров (91,7%), что указывает на инфекцию, перенесённую ранее. В пределах этой группы можно выделить подгруппу из 53 доноров (55,2%), у которых индекс авидности составлял 60-100%. Такие данные могут свидетельствовать о поздней стадии перенесённой первичной инфекции или инфекции, перенесённой в прошлом. Средний индекс авидности в интервале 30-60%, который наблюдается у 35 доноров (36%), можно рассматривать как переходной этап развития иммунного ответа, а именно, процесс формирования специфичности активного центра антител [13]. Известно, что динамика авидности иммуноглобулинов зависит от дозы антигена. При низкой вирусной нагрузке происходит более быстрое нарастание авидности, а большое количество вируса приводит к более медленному формированию авидности [14].
Таким образом, низкоавидные антитела продуцируются в течении первой стадии инфекции, когда содержание вирусных антигенов высокое. Также следует обратить внимание, что длительность периода циркуляции в организме низко- и среднеавидных антител может быть обусловлен индивидуальными особенностями функционирования иммунной системы. Поэтому окончательный вывод и интерпретацию полученных результатов можно сформулировать только после исследования динамики количества и индекса авидности антител, специфических к ВПГ2.
Таким образом, разработанная нами тест-система для определения антител к ВПГ2 с определением индекса их авидности даёт возможность устанавливать длительность и стадию инфекционного процесса, что может оказаться решающим фактором при выборе стратегии лечения.
Литература
- Марієвський В.Ф., Руденко А.О., Щербинська А.М. Инфекционные болезни в Украине на рубеже двух столетий. //Современные инфекции.-1999.-№2.-С.18-23.
- Кицак В.Я. Вирусные инфекции беременных: патология плода и новорожденных. – Кольцово, 2005. – 84 с.
- Казимирчук В.Е., Мальцев Д.В. Клиника, диагностика и лечение герпесвирусных инфекций человека. – К.: Феникс, 2009. – 352 с.
- Leyland B., Kennedy M.R., Wimberly Y.H., Levine B.J., Cherpes T.L. Serologic detection of herpes simplex virus type 2 antibodies among pregnant women using a point-of-care test from Focus Diagnostics. // Journal of Clinical Virology. – 2009. – Vol. 44, № 2. - P. 125-128.
- Slomka M.J. Seroepidemiology and control of genital herpes: the value of type specific antibodies to herpes simplex virus. // Commun Dis Rep CDR Rev. – 1996. – Vol. 1, №6(3). - Р. 41-45.
- Brown E.L., Morrow R., Krantz E.M. at all. Maternal herpes simplex virus antibody avidity and risk of neonatal herpes. // Am J Obstet Gynecol. – 2006. - Jul;195(1). – P. 4-6.
- Morrow R.A., Friedrich D., Krantz E., Wald A. Development and use of a type-specific antibody avidity test based on herpes simplex virus type 2 glycoprotein G. // Sex Transm Dis. – 2004. - Aug;31(8). – P. 508-515.
- Hashido M., Inouye S., Kawana T. Differentiation of primary from nonprimary genital herpes infections by a herpes simplex virus-specific immunoglobulin G avidity assay. // Journal of Clinical Microbiology. – 1997. – Vol. 35, № 7. – Р.1766-1768.
- Manservigi R., Cassai E. The glycoproteins of the human herpesviruses. // Comparative Immunology, Microbiology and Infectious Diseases. – 1991. – Vol. 14, № 2 - P. 81-95.
- Tijssen P., Kustak E. Higly efficient and simle metods for the preparation of peroxidase and active peroxidase antibody conjuigates for enzyme immunoassays // Analytical Biochemistry. – 1984. – Vol. 136, № 2. - Р. 451-457.
- Лапач С.Н., Губенко А.В., Бабич П.Н. Статистические методы в медико-биологических исследованиях с использованием Excel – К.: Морион, 2001. - 407с.
- Corey L. Challenges in genital herpes simplex virus management. // The Journal of Infectious Diseases. – 2002. – Vol. 15;186 Suppl 1. – P. 29-33.
- Скок М.В. Основи імунології. Курс лекцій – Київ: Фітосоціоцентр, 2002. – 152с.
- Meyers R.A. Immunology: from cell biology to disease. - Wiley-VCH, 2007. – 435р.